몰증발열은 뭘까요?
몰증발열은 액체 1 mol을 기화시키는 데 필요한 에너지로 정의됩니다. 에너지이기 때문에 단위가 kJ이겠죠?
분자 간 힘의 세기 척도로 표현됩니다.
예를 들어 봅시다.
분자 간 인력이 강하면 액체상에서 기체상으로 변화할 때 많은 에너지가 필요하게 됩니다. '많은 에너지가 필요? = 몰증발열이 크다'라고 표현이 가능합니다.
평형 증기압이랑 무슨 차이죠?
평협 증기압은 응축과 기화 사이에 동적 평형이 존재할 때의 증기압입니다. 보통 사용하는 증기압은 평형 증기압과 거의 비슷한 개념입니다. 그냥 단순하게 증기압이 얼마야?라고 물어보면 평형 증기압으로 생각해도 됩니다.
증기압(vapor pressure)
몰증발열(molar heat of vaporization)
결론적으로 몰당 필요한 에너지냐? 상이 변화기 위한 에너지냐? 의 차이로 보면 되겠습니다.
액체의 양에 따라 증기압이 변할까?
아닙니다. 평형 증기압은 액체가 약간 존재하는 한 액체의 양과 무관합니다.
증기압은 어떻게 알죠?
간단한 식을 통해 계산이 가능합니다.
Clausius-Clapeyron (클라시우스-클라페이런) 식을 통해 계산이 가능합니다.
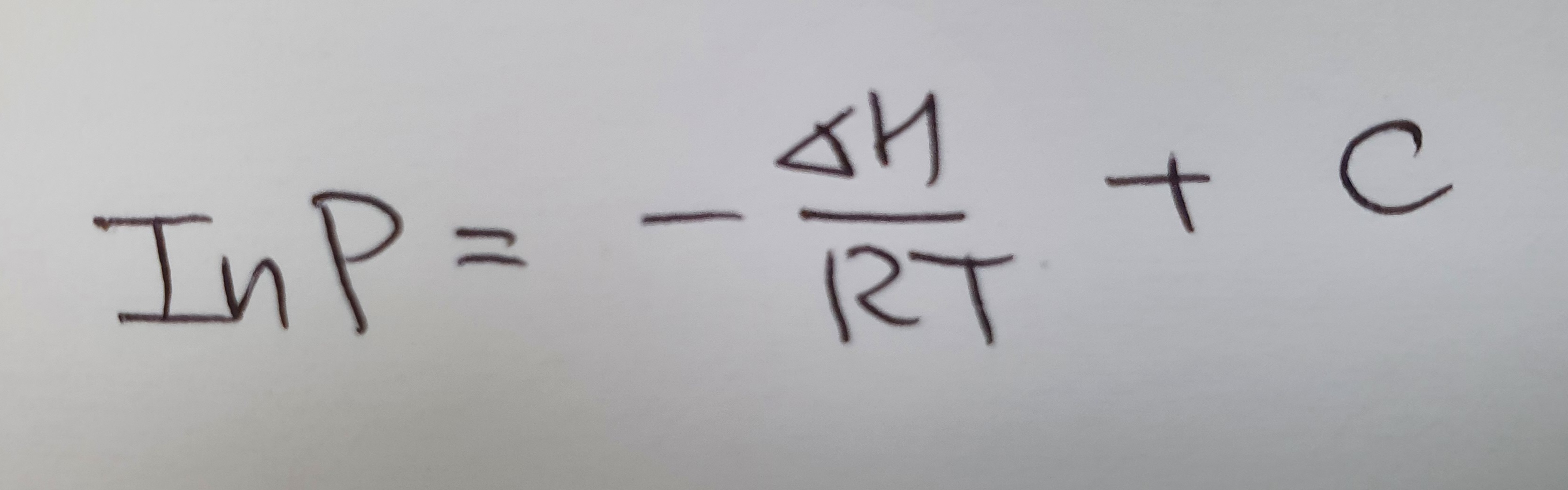
ln은 자연로그이고, R은 기체 상수입니다. (8.314 J/K-mol)
위의 식을 선형 방정식 형태로 바꾸면 y=ax+b이 됩니다.
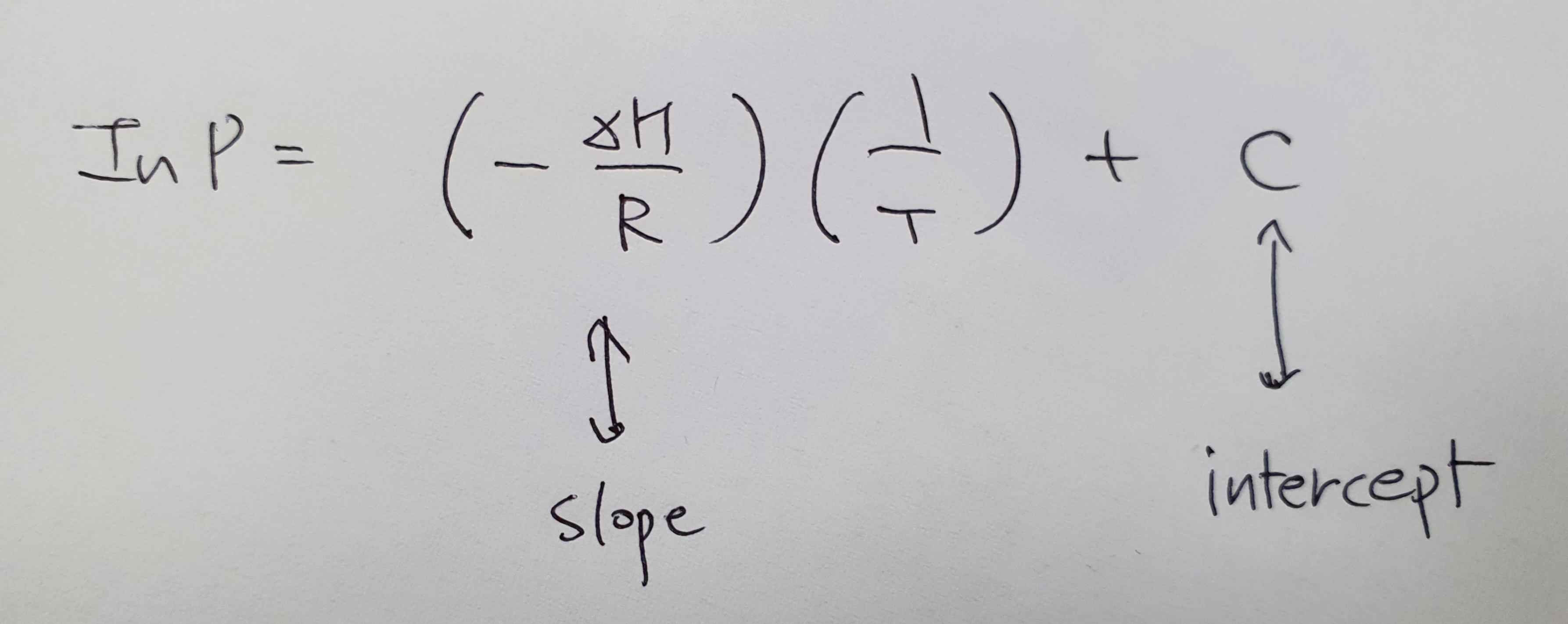
자자.. P를 알고 싶으면 H값과 T의 값만 알면 쉽게 계산이 됩니다.
한 온도에서 엔탈피와 증기압을 알면 다른 온도에서의 증기압 계산이 가능할까?
가능합니다.
어렵지 않아요. 아래 식에 대입만 하면 정말 쉽게 계산이 가능합니다.
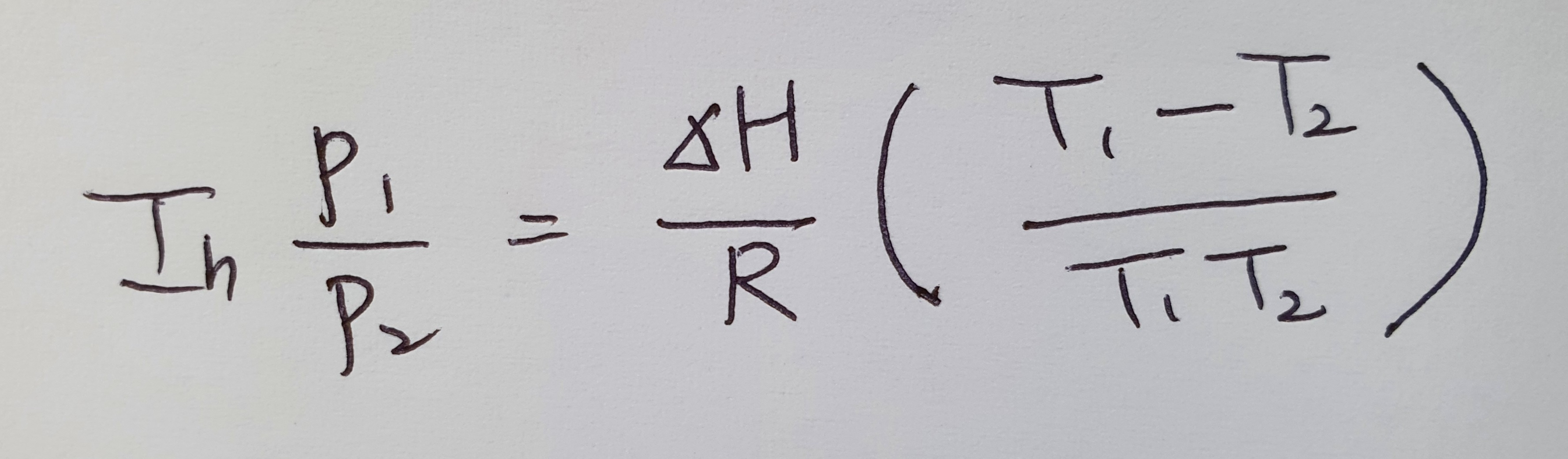
끓는점이랑 증기압의 관계?
끓는점(boiling point)은 증기압과 외부 압력이 같아지는 온도입니다.
잘 생각해보면 증기압은 온도에 따라 증가합니다. 온도가 증가하면 분자의 활동성이 증가하고 기화하려는 에너지가 증가하기 때문이죠. 어느 시점에 도달하면 증기압이 외부에서는 누르는 압력과 같아집니다. 이때가 끓은점입니다.
보통 우리는 외부 압력을 1 atm으로 생각하고 있기 때문에 1 atm에서의 기화되려는 에너지라고 생각하면 되겠습니다.
'Science Story' 카테고리의 다른 글
| pH는 어떻게 계산할까? (쉬움) (0) | 2022.06.02 |
|---|---|
| 암모니아 생산을 위한 Haber-Bosch process (0) | 2022.05.31 |
| 물의 밀도에 관한 재미있는 사실 (0) | 2022.05.31 |
| 방사선? 방사능? 방사성? 이 용어의 차이가 뭘까? (0) | 2022.05.17 |
| 원자력으로 에너지를 어떻게 만들까? (0) | 2022.05.16 |



